龙血竭及其主要活性成分对脑缺血的药理作用与机制
龙血竭为百合科龙血树属植物剑叶龙血树Dracaena cochinchinensis (Lour.) S. C. Chen含脂木材提取加工制成的树脂[1],主要分布于我国广西、云南、海南及东南亚国家柬埔寨、老挝等地。血竭以“活血圣药”著称,药用历史悠久,但我国血竭资源濒临匮竭,幸而在20世纪70年代,著名植物学家蔡希淘在云南发现了珍稀植物剑叶龙血树,并用该植物研制出首批“国产血竭”[2]。随后,于1990年以“广西血竭”为药材名获批国家一类新药材,1999年正式被国家药品标准[WS3-082(Z-016)-99(Z)]收载,纳入部颁标准药材,并更名为“龙血竭”[3]。龙血竭性温、平,味甘、辛、咸,无毒,具活血散瘀、消肿止痛、敛疮生肌等功效。现代药理学表明,龙血竭具有抗氧化应激、抗炎、抗血栓/血小板凝集、保护血脑屏障、抗肿瘤等广泛的药理活性[4],在国内外均受到学者的高度重视。
脑缺血/再灌注(ischemia/reperfusion,I/R)损伤是罹患脑缺血的关键环节,可引发氧化应激、炎症反应、细胞凋亡等一系列神经化学过程,成为脑缺血致死致残的关键原因之一。针对治疗脑缺血的研究从未停止,而治疗手段主要以溶栓为主,现唯一经美国食品药品监督管理局(Food and Drug Administration,FDA)批准的治疗药物组织纤溶酶原激活物仍存在不良反应多、适用人群少、治疗时间窗窄等难题。基于病理过程的复杂性及已有药物的局限性,可供选择的临床治疗药物的多元化、丰富性及安全性仍相对欠缺[5],探寻治疗脑缺血及脑I/R损伤的药物和临床策略已成为当前研究的热点与难点。众多研究表明,龙血竭缓解脑I/R损伤作用良好,且作用特点与脑I/R损伤的复杂病理过程相符,能够针对脑缺血的发生发展过程产生不同疗效。
目前少有综述系统地对龙血竭及其活性成分在脑缺血疾病中的药理作用进行总结。含有龙血竭酚类成分如龙血通络胶囊(Longxue Tongluo Capsule,LTC)与龙血竭滴丸等药物在临床上治疗脑缺血均呈现出一定的疗效,但目前的研究仅局限于实际疗效观察,而药物机制研究方面相对模糊。基于此,本文将着重梳理归纳龙血竭及其主要活性成分抗脑缺血的相关药理作用及其可能的作用机制,尤其关注其活性化合物的抗脑缺血作用,对龙血竭的综合利用与进一步科学研发具有重要意义。
1 化学成分及含量概述
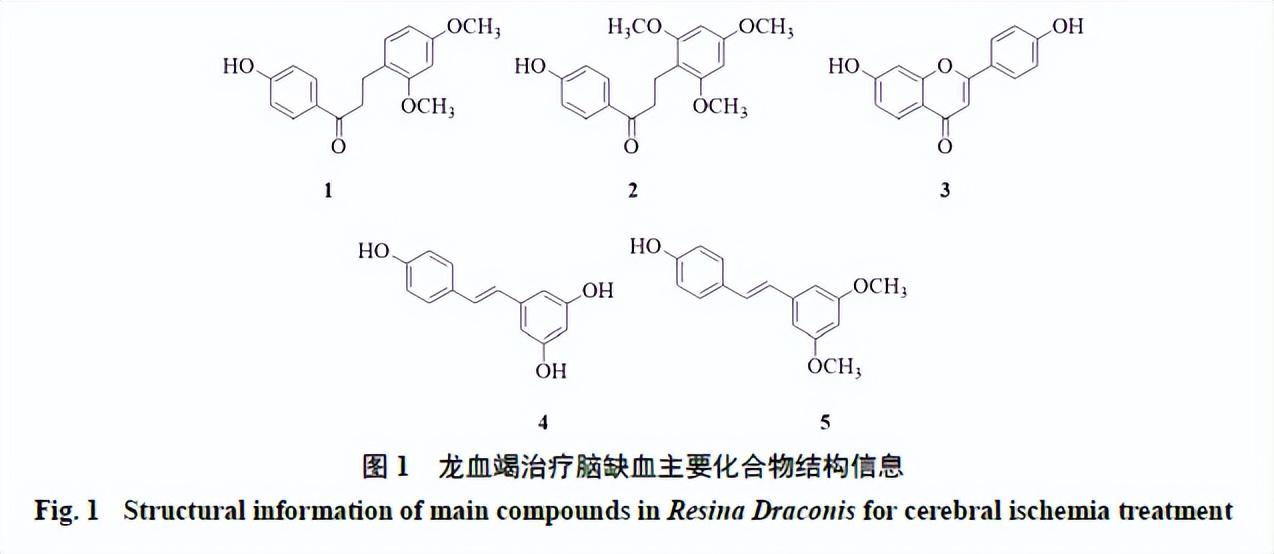
现代研究表明,酚类、萜类、甾体类等成分是龙血竭的主要化学成分,而其主要的活性成分以酚类化合物为特征。迄今,已从龙血树属植物中分离检测出17种萜类、甾体及甾体皂苷类成分物质,如4-烯-3-胆甾酮、胆甾醇、豆甾醇等[6],以及180多种酚类化合物[7],以类黄酮、二苯乙烯为母核的化合物是其含量较为丰富和主要的药效成分,类黄酮占龙血竭总量的50%~80%[7-9],其中分离鉴定出黄酮类80余种,包括二氢查耳酮类化合物(龙血素A、龙血素B)、查耳酮类化合物(2,4,4′-三羟基查耳酮、2′-甲氧基-4,4′-二羟基查耳酮)、黄烷类(4′,7-二羟基- 3′-甲氧基黄烷、7-羟基-4′-甲氧基黄烷)、聚合黄酮类(剑叶血竭素)等[6,10]。
提取出的多个活性物质(化学结构见图1),如黄酮类成分龙血素A(1)、龙血素B(2)、7,4′-二羟基黄酮(3)、二苯乙烯类成分白藜芦醇(4)、紫檀茋(5)[11],具有抗氧化、抗炎、神经保护、抗肿瘤和抗血栓等作用。
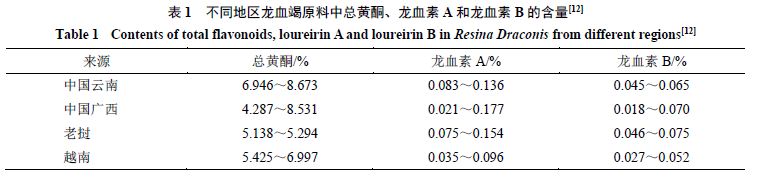
不同地域来源的龙血竭中主要成分含量存在一定差异,见表1。此前,有研究系统地对来源于中国广西、中国云南和老挝、越南4个产地多批次龙血竭药材中总黄酮、龙血素A及龙血素B的含量进行测定,发现三者含量相对较高的药材产地分别为中国云南、中国广西及老挝[12]。另采用代替对照品法测定发现中国云南、老挝产龙血竭药材中龙血素A与龙血素B含量比为(3~9)∶1,龙血素A含量较高但存在一定差异,使不同产地的龙血竭药材易于辨识[13]。
新近研究对源于剑叶龙血树及岩棕2种基原龙血竭43份样品中5种活性成分进行含量测定,各成分含量变化范围为龙血素A(0.41%~8.92%)、紫檀茋(0~3.96%)、龙血素B(0~2.18%)、白藜芦醇(0~1.10%)、7-4'-二羟基黄酮(0.04%~0.56%),龙血素B在2种基原龙血竭中含量差异极为明显,岩棕龙血竭中龙血素B质量分数(1.039 4±0.495 5)%约为剑叶龙血竭中龙血素B质量分数(0.1105±0.150 7)%的9.4倍[11]。以上研究提示龙血竭各活性成分含量存在一定差异。各产地间含量差异较大。
另外,研究比较广西、云南产9个批次龙血竭中龙血素A与龙血素B的质量分数差异,发现平均质量分数分别为0.47%和0.96%[14]。经反相高效液相色谱法测定发现2个不同厂家龙血竭产品中紫檀茋质量分数分别为5.50、14.72 μg/mg[15],差异明显。不同地域、基原、厂家的龙血竭中总黄酮含量无显著性差异,但其活性成分含量均有明显差异,尤其是龙血素A、龙血素B、紫檀茋等,说明不同基原植物中龙血竭的品质间存在明显差异[16-17]。
2 抗脑缺血药理作用
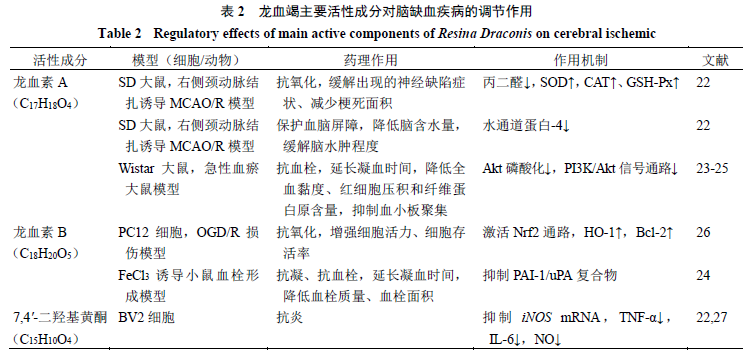
龙血竭对多器官I/R损伤有较好的保护作用,能改善新西兰兔、树鼩、大鼠心肌以及大鼠肾脏I/R损伤后的组织结构损伤[18-21]。研究表明,龙血竭及其活性成分具有抗氧化、抗炎、保护血脑屏障及改善血流状态等作用,能够影响脑缺血病理过程中的氧化应激、炎症、血脑屏障破坏、能量代谢等多个环节,药理作用见表2、图2。

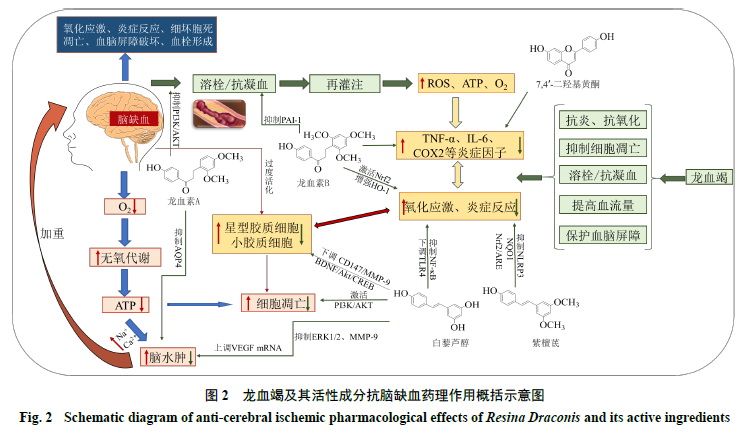
2.1 抗氧化应激
近年,多项研究报道龙血竭及其主要活性成分在抗氧化应激方面表现出良好的作用。紫檀茋、白藜芦醇、龙血素B、龙血素A等均能够通过改善氧化应激标志物并调节过氧化物酶活性途径发挥抗氧化损伤作用从而保护脑组织。
经较系统的体外抗氧化活性研究,发现龙血竭胶囊质量浓度为0.05~0.40 mg/mL对1,1-二苯基-2-苦肼基自由基清除能力较强并呈一定的浓度相关性,半数抑制浓度(median inhibition concentration,IC50)为0.14 mg/mL。在此基础上进一步研究发现,龙血竭胶囊不仅能显著清除由NADH-PMS-NBT系统产生的O(IC50=0.24 mg/mL)、羟自由基(IC50=0.057 mg/mL),还能抑制脂质过氧化(IC50=0.18 mg/mL),作用效果较抗坏血酸(IC50=0.27 mg/mL)
显著。在β-胡萝卜素/亚油酸的自氧化体系中,龙血竭胶囊质量浓度仅在0.1 mg/mL时,抗氧化能力便可达到37.8%[56],多体系相互验证共同证实龙血竭胶囊具有较强的抗氧化能力。另采用薄层色谱-生物自显影法,以对照品峰面积/总峰面积为指标评估化合物的抗氧化活性,发现龙血竭胶囊中各成分抗氧化活性分别为:紫檀茋(25.69%~42.72%)、龙血素B(6.83%~19.34%)、白藜芦醇(7.24%~14.04%)、龙血素A(5.50%~14.20%)[57],表明龙血竭胶囊在体外具有一定的抗氧化活性。
周艳林等[58]采用建立高效液相色谱-二苯基三硝基苯肼在线法评估龙血竭活性成分的抗氧化能力,发现紫檀茋(清除率73.19%)与白藜芦醇(清除率71.10%)抗氧化能力相当,而在保护人红细胞膜免受脂质过氧化作用中紫檀茋 [IC50为(44.50±7.80)µmol/L] 优于白藜芦醇[59],龙血素B(清除率39.01%)以及龙血素A(清除率12.14%)较前两者有明显差异。以上研究提示二苯乙烯类紫檀茋的抗氧化能力较强,二氢查耳酮类化合物苯环上甲氧基发生取代成为对称结构时其抗氧化能力也得到增强,但C-7,4′位羟基取代的7,4′-二羟基黄酮未显示出明显的抗氧化活性,表明龙血竭中主要的抗氧化活性成分为二苯乙烯类与二氢查耳酮类。
龙血竭滴丸、龙血竭片及LTC均以改善氧化应激标志物和过氧化物酶活性的方式调节氧化应激[60-62]。包括显著升高SOD、GSH-Px、CAT、乳酸脱氢酶水平,以及降低丙二醛、iNOS、NOS、一氧化氮含量,以此提高大脑MCAO大鼠的抗氧化能力,改善局灶性脑缺血大鼠神经功能,发挥脑保护作用。其中二苯乙烯类化合物紫檀茋发挥抗氧化应激作用已被证实[35,63],其具有抗氧化、清除自由基的特性,能显著调节脑组织中抗氧化酶的表达并降低氧化应激水平,以消除体内缺血性损伤引起的氧化应激[64]。
Khan等[65]对雄性SD大鼠(180~220 g)采用双侧颈总动脉闭塞30 min再灌注60 min制备脑损伤模型,随后ig给予紫檀茋(400 mg/kg)干预10 d,发现紫檀茋可显著改善脑I/R大鼠的神经行为学,降低脂质过氧化反应、谷胱甘肽、亚硝酸盐浓度,以及恢复CAT活性,显著减轻氧化损伤。进一步研究发现其机制与抑制NLRP3炎性小体和催化亚基gp91phox相关的氧化应激有关[28]。紫檀茋(20 μmol/L)能够增加过氧化氢(hydrogen peroxide,H2O2)处理后脊髓神经元细胞中的LC3-II蛋白质表达水平与自噬体数量,从而抑制细胞活性氧产生,发挥抗氧化应激作用[29]。体外细胞实验和在体缺血再灌注动物实验均显示紫檀茋具有较好的抗氧化应激能力。
研究证实白藜芦醇对脑I/R具有防御治疗作用与抗氧化应激特性有关[66-67]。给予雄性Wistar(280~300 g)大鼠白藜芦醇纳米颗粒预处理10 d后(500 μg,ip),可显著降低MCAO大鼠缺血2 h后的梗死面积(与模型组相比梗死面积下降了68.37%),改善运动和认知功能,提高谷胱甘肽含量,调节抗氧化酶(GPx、GR、GST、SOD、CAT)的活性[36]。白藜芦醇还能通过降低I/R大鼠的丙二醛水平,发挥显著的抗氧化活性,同时能显著提高Nrf2和HO-1水平,表明其机制与激活Nrf2/ARE信号通路有关[37]。
龙血素A与龙血素B都具有抗氧化应激活性。龙血素A能透过血脑屏障在大鼠脑组织分布,可能直接作用于中枢神经系统发挥作用[68]。杨波等[22]采用线栓法建立雄性SD大鼠右侧MCAO/R模型,给予龙血素A(60、120 mg/kg)干预后可显著缓解出现的神经缺陷症状,明显降低水通道蛋白-4、丙二醛水平,提高抗氧化酶(SOD、CAT、GSH-Px)活性,减少梗死面积与脑水肿程度。与其结构相似的龙血素B也具有明显的抗氧化作用,浓度为10 μmol/L时可明显改善体外OGD/R对PC12细胞的损伤作用,其机制与Nrf2通路激活、增强HO-1和Bcl-2表达有关[26]。
2.2 抗炎反应
龙血竭抗炎作用效果显著,在抑制脑、心脏、肠、肝、肺等器官及组织炎症方面发挥较好作用[69-71]。据临床研究,采用龙血竭散联合创灼膏或龙血竭乙醇溶液加金黄散外敷治疗静脉炎总有效率均高达100%[72-73]。再者,龙血竭散联合美沙拉嗪治疗重度溃疡性结肠炎患者总有效率为72.2%~92.5%[74-77],龙血竭片联合固肠止泻丸治疗总有效率达97%[78]。提示龙血竭具有较强的抗炎活性。研究发现龙血竭可降低颅脑损伤模型大鼠血清中TNF-α以及IL-6含量,从而减轻炎症反应,对颅脑损伤起保护作用[79],龙血竭降低TNF-α、IL-6的作用也在大鼠放射性脑损伤抗炎的研究中得到证实,可缓解内源性神经毒素加重辐射诱导的神经炎症[80-81]。
脑缺血过程中,过度活化的星形胶质细胞会释放多种促炎因子,增强神经炎症反应,加重脑组织损伤[82-83],因而针对性抑制星形胶质细胞活化可成为减轻炎症反应的有效手段,进一步缓解脑组织损伤。在体研究表明,白藜芦醇可明显抑制MCAO大鼠模型中星形胶质细胞活化,减少脑损伤并改善神经功能[38],体外研究亦报道[84],白藜芦醇预处理24 h可抑制OGD/R后星形胶质细胞增殖活化,进而降低促炎因子TNF-α、IL-1β及增强抗炎因子IL-10、β-干扰素的表达,减轻炎症反应。
在脑I/R的炎症反应中,NF-κB能通过激活NLRP3炎性小体及星形胶质细胞活化而产生促炎因子,选择性抑制NF-κB可降低星形胶质细胞活化,可能成为减少中枢神经系统炎症损伤的有效途径[39,85]。在MCAO/R小鼠模型及经OGD/R的HT22/U251共培养模型中均发现紫檀茋能够减少TNF-α、IL-1β、IL-6、COX-2、iNOS、组胺、前列腺素E2等炎症细胞因子的产生及下调MMPs,如MMP2和MMP9的表达。进一步对机制研究发是通过抑制NF-κB磷酸化从而减轻脑I/R损伤后星形胶质细胞活化所诱导的炎症反应,进而对脑I/R损伤起到抗炎作用[30-31]。
脑内小胶质细胞在缺血性脑损伤神经炎症中起到关键作用,脑缺血导致小胶质细胞过度活化、炎性因子过表达,从而扩大脑梗死范围,加重脑损伤。研究表明,龙血竭乙醇提取物、龙血竭片及LTC均能明显减少相关炎性因子释放(IL-1β、IL-6、一氧化氮)[86],发挥抗炎作用改善脑损伤,其机制与调节脂多糖(lipopolysaccharide,LPS)诱导的COX-2基因表达抑制小胶质细胞活化有关[87-91]。小胶质细胞的激活可分为M1与M2表型,M1型起促炎作用加重脑损伤,而M2型则发挥抗炎作用参与修复重构损伤组织。
研究已证实MicroRNA-155(miR-155)可促进小胶质细胞的M1极化使神经炎症反应增加。以C57/BL小鼠构建MCAO模型,在缺血0、8、18 h后腹腔注射白藜芦醇(100 mg/kg),发现白藜芦醇可降低miR-155的表达,从而抑制小胶质细胞M1极化,降低M1特征基因CD32和IL-1β的表达以及IL-1、IL-6含量,促进小胶质细胞M2极化,显著增加其特征基因CD206和ARG-1的表达与IL-4、IL-10含量,有效减少脑缺血后的神经炎症[40]。亦
有研究表明,MCAO小鼠给药白藜芦醇后(1×10−7 mol/L),抑制小胶质细胞的过度激活,减少炎症因子释放(IL-1β、IL-6、TNF-α),从而减轻缺血性脑损伤相关炎症反应,进一步机制研究表明可能与下调CD147/MMP-9通路、调节BDNF/Akt/CREB及TREM1/2的表达失衡有关[41-42]。此外,龙血竭中7,4′-二羟基黄酮对小胶质细胞亦表现出较好的抗炎活性,仅在较低浓度下就能明显抑制BV2细胞的IL-6分泌,并抑制LPS诱导BV2中一氧化氮的产生,可能通过减少过度激活的小胶质细胞中iNOS、IL-6和TNF-α的表达从而抑制神经炎症[26-27]。
近期有研究首次从龙血竭中提取出含有3个手性碳的黄酮三聚体化合物(nordracophane),并发现该化合物能有效抑制LPS刺激RAW264.7细胞释放一氧化氮 [IC50为(14.9±4.5)μmol/L],表现出一定的抗炎作用[92]。
龙血竭活性成分紫檀茋与白藜芦醇均以抑制星形胶质细胞及小胶质细胞活化的方式降低相关炎症因子释放,从而发挥抗炎作用,且现有机制研究提示龙血竭抗脑I/R损伤作用可能与抑制相关细胞活化、NF-κB磷酸化、NLRP3炎性小体激活有关。龙血竭中仍可能具有其他潜在的抗炎新成分,对其进行更深入的挖掘将有助于新型抗炎药物的研发,对脑缺疾病相关炎症反应的治疗具有重要意义。
2.3 神经保护作用
龙血竭乙醇提取物(50 μg/mL)能够明显降低Bax/Bcl-2的值[93],增加脑源性神经因子的表达,降低促凋亡Caspase-3的表达,从而抑制60Co-γ射线照射引起的大鼠海马神经元凋亡,对神经元损伤起到保护作用[81]。体外研究发现LTC可部分逆转H2O2诱导的PC12细胞损伤,提高神经细胞存活率,降低神经细胞凋亡率,提示LTC具有一定的神经保护作用[94]。新近研究表明,LTC可降低MCAO大鼠梗死面积、改善脑组织病理状态,从而保护脑神经元细胞免受I/R损伤,其机制与减轻内质网应激和MAPK介导的机制最终抑制Caspase依赖的细胞凋亡有关[95]。
研究已证实白藜芦醇能抑制神经元凋亡[96],显著改善脑组织损伤后的神经功能[38]。通过对SD大鼠(250~300 g)采用线栓法制备MCAO模型,I/R 2 h后给予白藜芦醇(40 mg/kg)干预,发现干预后大鼠神经功能评分、脑组织损伤程度、神经元结构破坏程度、神经元数量及梗死侧神经元凋亡的发生均有明显改善,其保护机制与下调p-JNK、p-p38的水平有关[43]。
此外,白藜芦醇能够增加抗凋亡基因如Bcl-2的mRNA水平及改变相关基因Bax、Bcl-2、Caspase-3的表达从而减少缺血相关细胞死亡达到抗凋亡作用[44]。Akt信号通路在脑、心等器官I/R损伤中发挥抑制细胞凋亡的作用[45-46]。白藜芦醇能够通过调节miR-223-3p/NLRP3通路减少皮质神经元死亡并激活PI3K/Akt通路抑制内皮细胞凋亡,从而发挥对神经元及内皮细胞的保护作用[47-48]。另有报道称[49],白藜芦醇通过调节JAK/ERK/STAT信号通路显著降低脑I/R诱导的JAK、ERK、STAT和JNK磷酸化水平,保护海马神经元免受脑I/R损伤。
研究表明给予脑缺血大鼠及异烟肼诱导神经损伤的斑马鱼紫檀茋(0.5 μmol/L、10 mg/kg)后,脑内神经元存活率明显增加[32-33]。另外,以不同浓度的紫檀茋(1.25、2.50、5.00 μmol/L)对小鼠海马神经元细胞(HT22)OGD/R损伤的保护作用进行探究,发现神经元存活率与紫檀茋浓度呈一定的量效关系,各浓度下细胞存活率依次为(55.45±3.62)%、(67.23±4.37)%、(81.87±5.02)%,且免疫印迹试验结果显示随紫檀茋浓度增加,Bax/Bcl-2的值递次降低,提示紫檀茋对神经元细胞OGD/R损伤有一定的保护作用[34]。龙血竭及其活性成分通过对抗脑缺血诱导的神经元凋亡,提高神经元存活率,有效抑制神经元凋亡,对受损神经元有一定的保护作用。
2.4 血脑屏障保护作用
血脑屏障完整性受损是脑I/R损伤的早期关键事件,脑I/R损伤会破坏血脑屏障完整性,从而破坏脑组织正常功能,而血脑屏障功能结构破坏能加剧脑I/R损伤的病程[97]。因此,保护血脑屏障对改善脑I/R损伤具有重要意义。
脑缺血引起血脑屏障高通透性使血液成分、高分子物质外渗而导致血源性水肿及出血性转化可引起无法逆转的二次损伤[98]。血脑屏障通透性成为脑缺血治疗的重要切入点。已有研究表明,MCAO模型大鼠连续给药龙血竭14 d后,高剂量组(2.60 g/kg)脑梗死体积(32.42±2.57)%和脑组织含水量(70.31±1.15)%均显著降低,神经受损恢复效果最好。龙血竭滴丸与LTC均能明显降低局灶性脑缺血大鼠的脑含水量,且作用呈剂量相关性趋势[60-61]。
白藜芦醇对维持血脑屏障功能具有较好的作用[68],脑缺血模型大鼠ip白藜芦醇(100 mg/kg)24 h后能够显著降低大分子渗透标志物髓过氧化物酶活性及伊文思蓝(EB)的含量,同时显著降低缺血侧脑组织含水量。另有研究用干湿质量法证实白藜芦醇40 mg/kg也能显著降低MCAO模型大鼠脑组织含水量(77.65±4.02)%[51]。进一步研究发现白藜芦醇可通过抑制ERK1/2-VEGFA信号级联和减弱CAV-1的上调来抑制细菌渗透和降低血脑屏障通透性,显著抑制脑膜炎大肠杆菌侵袭血脑屏障,以及下调ICAM-1和VCAM-1,改善MCAO大鼠血脑屏障通透性、血脑屏障超微结构,减轻I/R后脑水肿程度[51-52]。
其他活性化合物同样表现出较好的改善血脑屏障通透性作用,脑IR模型小鼠连续给予紫檀茋5 d后,发现小鼠脑水肿程度及Na+浓度均以剂量相关性趋势减轻,剂量为10 mg/kg时效果最为明显[35]。其他活性化合物同样表现出较好的改善血脑屏障通透性作用,脑IR模型小鼠连续给予紫檀茋5 d后,发现小鼠脑水肿程度及Na+浓度均以剂量相关性趋势减轻,剂量为10 mg/kg时效果最为明显[22]。以上研究表明龙血竭及其活性化合物可通过降低血脑屏障通透性从而使脑组织含水量降低,减轻脑水肿,发挥保护脑组织作用[70]。
血管内皮细胞作为血脑屏障的基本结构和主要成分,在维持血脑屏障完整性方面发挥重要作用,是脑缺血治疗的关键位点。研究已发现龙血竭酚类提取物能减轻内皮细胞功能障碍,LTC在质量浓度为10 mg/L时可提高OGD/R损伤下人脐静脉内皮细胞细胞的存活率,有效保护缺氧环境下的内皮细胞[68]。此外,其对氧化低密度脂蛋白模拟的人脐静脉内皮细胞损伤也具明显的保护作用,并发现机制与抑制OGD/R诱导线粒体相关Caspase3/9通路的激活有关[53-54]。活性成分白藜芦醇(40 mg/kg)给药后对MCAO模型大鼠的血脑屏障超微结构恢复起到一定作用,其血脑屏障组成成分星形胶质细胞、内皮细胞等细胞结构均较完整,损伤程度比模型组轻[51]。
现有研究证实白藜芦醇对血管内皮细胞的干预能有效激活Wnt/β-catenin信号通路,增加闭合蛋白-5与咬合蛋白的表达,降低血脑屏障的通透性,从而逆转血脑屏障的破坏[55]。脑I/R后会引起内皮细胞损伤,从而发生内皮间质转化,研究发现紫檀茋(10 mg/kg)可显著抑制MCAO大鼠内皮间质过度转化,其作用机制可能与激活Akt/GSK-3β通路有关[99]。内皮细胞外连接的基底膜是血脑屏障的另一个重要屏障,其中细胞外基质与血管基底膜维持血脑屏障完整性的重要结构均为基质MMPs的底物。脑I/R损伤后MMP-9表达明显增加,会引起闭合蛋白降解,增加微血管通透性进而形成脑水肿。白藜芦醇能抑制MMP-9的活性,增加TIMP-1活性维持血脑屏障完整性,从而减轻脑水肿缓解脑I/R损伤[100]。
龙血竭对脑缺血后血脑屏障完整性具有保护作用,能通过减轻内皮细胞功能障碍,保护血管基底膜共同维持血脑屏障通透性和完整性。其中,活性物质白藜芦醇对血脑屏障保护作用较强,能维持血脑屏障组成细胞的结构完整性,并在抗脑水肿方面作用突出,发挥较强的抗脑缺血作用。
2.5 抗血栓、血小板聚集
抑制血栓形成是针对脑缺血治疗中的另一重要方面。龙血竭乙醇提取物在大小鼠血栓模型中已被证实具有良好的抗血栓作用,龙血竭临床抗血栓作用与低分子肝素相似,对髋部骨折手术患者深静脉血栓形成的作用效果明显[23,101]。临床上联合使用龙血竭片与生肌止痛熏洗剂治疗血栓性外痔的总有效率达到100%[102]。LTC用于治疗脑梗死恢复期血瘀证,在大鼠与比格犬90 d长期毒性试验研究中未见明显的毒性,临床上可有效改善卒中恢复期神经功能缺损和病残情况[103]。另有研究探讨LTC与舒肝解郁胶囊及长春西汀联合用药治疗血栓性脑梗死恢复期的临床效果,发现能够促进脑部血液循环、缓解患者临床症状进而加快康复进程。临床治疗有效率高达93.06%,且无明显不良反应,治疗效果安全可靠[104-105]。
此外,龙血竭总酚滴丸可引起局灶性脑缺血损伤大鼠脑血管的血流量明显增加,显著减少大脑梗死体积,改善大脑神经功能[106]。梁楠等[107]使用龙血竭总酚滴丸干预麻醉犬也有类似发现,使得犬麻醉后的脑血流量明显增加,剂量为35 mg/kg时,在1 h内便可显著降低犬脑血管阻力,改善脑缺血状态,恢复脑梗死的神经功能。PAI-1异常表达会导致体内凝血和抗凝血系统紊乱引发血栓形成[108]。
脑缺血部位通过诱导PAI-1和降低血浆组织型纤维蛋白溶酶原激活物水平从而促进纤维蛋白凝块形成,加重脑损伤[109]。研究已证实龙血素B为PAI-1抑制剂[24],能显著提高血纤维蛋白溶解速率,其与抑制PAI-1/uPA复合物形成呈现一定的量效关系。在FeCl3诱导小鼠血栓形成模型中,龙血素B的干预使得小鼠出血时间延长到原来的50%~90%,血栓质量显著降低,与此同时血管内血栓形成面积显著减小,抗血栓作用明显。
LTC对体外二磷酸腺苷/血小板激活因子诱导的大鼠/兔血小板聚集具有抑制作用,改善血瘀性大鼠血液流变学,对局灶性脑缺血后脑组织损伤有明显的保护作用[103]。另外,龙血竭-β-环糊精包合物(500 mg/mL)对水杨酸、二磷酸腺苷、血小板活化因子诱导的兔血小板聚集均呈浓度相关性抑制作用,抑制率均高达99%[110]。龙血素A能抑制大鼠体内、体外血栓的形成并延长大鼠的体外凝血时间,降低全血黏度、红细胞压积和纤维蛋白原含量,机制与抑制血小板中PI3K/AKT信号通路的活性有关[23,111]。
近期研究发现,龙血素A抑制胶原蛋白、凝血酶、二磷酸腺苷等活性,从而抑制血小板聚集,其抗血小板活性和改善血流状态等机制与消除Akt在Ser473位点磷酸化有关[25]。以凝血酶为受体,发现在不同浓度下龙血素A体外凝血酶活性高于龙血素B[112],提示龙血素A及龙血素B对血小板的聚集有着较强的抑制作用,都能从不同程度上缓解脑缺血后造成的血栓形成与血小板聚集。
3 总结与展望
龙血竭因多种药用功效备受关注,其治疗脑缺血具有疗效确切、多靶点作用、安全性高等优势。本文从抗氧化应激、抗炎、神经保护、保护血脑屏障、抗血栓等药理作用5个方面对龙血竭及其主要成分治疗脑缺血的最新研究进展进行综述。酚类成分是龙血竭发挥抗脑缺血作用的主要药效物质之一,其中紫檀茋、白藜芦醇、龙血素B等是其重要的代表性成分。目前的研究提示,龙血竭治疗脑缺血特点与脑缺血多因素发病机制有一定的契合度与相关性,具备良好的潜在优势及开发价值,具有较好的临床应用前景。
尽管龙血竭抗脑缺血药理作用的研究渐趋明朗,但目前的研究尚存不足,尤其机制探究与靶点验证方面仍需研究者们着力深入研究。多数实验研究表明龙血竭及其单体化合物可通过信号通路或作用靶点发挥抗脑缺血作用,且主要集中于单体成分与机体的纵向关联,但较少有研究聚焦于各通路之间的协同或串扰作用的横向联系。改善脑I/R损伤、抗氧化应激、抗炎作用等方面与各成分间相互作用有着紧密联系。这就使得研究者们未来可从成分间相互作用角度出发对龙血竭抗脑缺血作用做进一步探讨。另外,其他单体成分是否具有类似作用,以及现有成分的更深入抗脑缺血分子机制,仍需挖掘。
在多种属动物模型中全面探究龙血竭抗脑缺血成分的作用过程,并于相应细胞模型中验证其分子机制仍是未来研究方向之一,如转基因动物、具独特脑部结构优势的沙鼠、兔、小型猪以及灵长类的猕猴、食蟹猴等。还可通过更完善的体内外脑缺血模型体系,探究龙血竭抗脑缺血复杂病理过程与治疗机制之间的联系,揭示其抗脑缺血整体效应的科学本质,为更好地把握运用龙血竭治疗脑缺血奠定基础。